La inyección de insulina es un ritual diario para millones de personas que luchan contra la diabetes. Pero, ¿se ha preguntado cómo se fabrica este tratamiento? La respuesta está en una proteína recombinante, cuya producción es fundamental para que esta y otras enfermedades sean controladas de una manera más efectiva y accesible.
Eso es justo lo que hacen los investigadores del Instituto de Errores Innatos del Metabolismo de la Pontificia Universidad Javeriana, quienes desarrollaron un método para que estas proteínas puedan ser más eficaces en el tratamiento de enfermedades como la hemofilia, las mucopolisacaridosis (MPS) y un gran número de enfermedades raras, así como otras más frecuentes como el cáncer, lo que los convirtió en los ganadores del Premio Bienal Javeriano a la Innovación 2023.
¿Qué es una proteína recombinante?
Empecemos por entender qué son las proteínas y a cuáles llamamos recombinantes. Las proteínas son macromoléculas que están dentro de las células y desempeñan tareas esenciales para el funcionamiento de los organismos vivos.
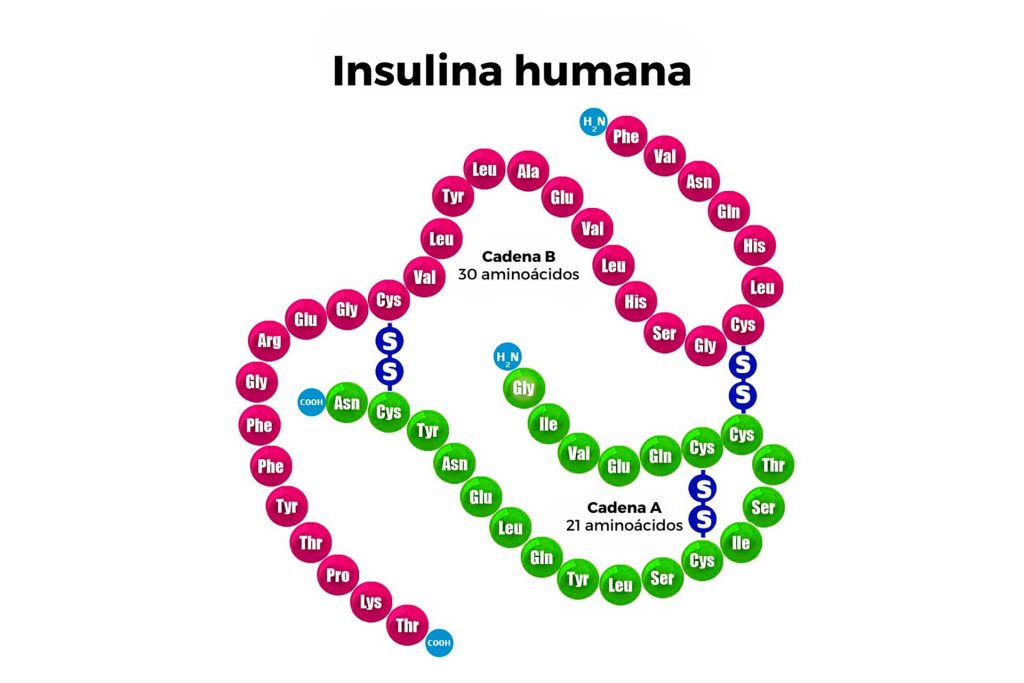
Por ejemplo, la hemoglobina es una proteína que transporta el oxígeno desde los pulmones a los tejidos a través de la sangre; el colágeno es una proteína que brinda elasticidad y resistencia a la piel, los tendones y otros tejidos; o la insulina que mencionamos al inicio, que ayuda a mantener estables los niveles de azúcar en sangre.
Su estructura se asemeja a la que tienen los bloques de LEGO. Cada una cumple una tarea específica para ensamblarse de manera adecuada.
Las proteínas recombinantes se crean mediante ingeniería genética, para compensar aquellas que no se producen de forma natural en el cuerpo. “Se producen usando información genética que le colocas a un organismo diferente al original que la produce”, explica Carlos Alméciga, director del Instituto de Errores Innatos del Metabolismo, de la Pontificia Universidad Javeriana.
Por ejemplo, la insulina es una proteína que se produce de forma natural en el páncreas; sin embargo, como algunas personas o animales no producen la cantidad o calidad suficiente, la ciencia ha permitido que esta proteína se cree en laboratorios para suplir esta necesidad.
“Tomamos el gen que tiene la información para producir naturalmente la proteína y la colocamos en una célula que obliga a que se genere la proteína. Esa proteína que se produce ahí se llama recombinante porque usas su información original y la estás colocando en un organismo diferente al que normalmente la produce, utilizando unas técnicas de biología molecular con las que básicamente manipulas ese organismo para que produzca la proteína que tú quieres generar”, puntualiza Alméciga, quien además es químico farmacéutico y doctor en Ciencias Biológicas.
La clave para que estas proteínas funcionen adecuadamente es la glicosilación, un proceso natural que permite la unión de azúcares a las proteínas. ¿Y por qué es importante? Porque, en caso de que el cuerpo no las produzca correctamente, se pueden añadir azúcares a proteínas recombinantes para mejorar la compatibilidad de estas con las células humanas, logrando medicamentos más seguros y eficaces.
“Para que el 80 % de las proteínas cumplan su función tienes que añadirle azúcares. En algunos casos, esto es lo que permite que la proteína ingrese a la célula”, añade el investigador.
Además, la glicosilación desempeña un papel crucial en la regulación de la respuesta inmunológica del organismo. Determinan si el sistema inmunológico las reconoce como propias o extrañas, y esto es fundamental para evitar respuestas inmunitarias inapropiadas y trastornos autoinmunes.
En pocas palabras, la glicosilación no solo hace que los medicamentos sean más efectivos, sino que también reduce los riesgos asociados a reacciones adversas del sistema inmunológico.
Todo esto es importante para el tratamiento de muchas enfermedades y, gracias a la investigación liderada por Alméciga, este proceso podría experimentar un cambio que abra las puertas a terapias médicas más avanzadas.
Innovación para mejores tratamientos médicos
Este equipo de investigadores, conformado por Edwin Alexander Rodríguez, Nico Calleware y Ángela Johana Espejo Mojica, y liderado por Alméciga, se dio a la tarea de desarrollar una plataforma de vanguardia que permitiría producir este tipo de proteínas en un microorganismo inusual: levadura, similar a la que se utiliza en panadería.
Pero ojo, no basta con utilizar levadura común. “Lo que hicimos fue coger esa levadura y la manipulamos para que fuera capaz de hacer proteínas recombinantes seguras en el uso con humanos. Esa levadura funciona como una fábrica que produce proteínas de origen humano. Es decir, tomamos la información genética que se encarga de producirla y así la fábrica hace la nueva que le pedimos”, comenta Alméciga.
Normalmente, estas proteínas se producen usando células de ratón o de primates, por lo que la glicosilación es parecida a la que hacemos los humanos ya que también son mamíferos, pero el problema, según explica el investigador, es que lo hacen de manera heterogénea y no se obtienen siempre las mismas glicosilaciones, lo que afecta la eficacia de los tratamientos.
“Nuestra plataforma nos permitiría generar estas proteínas de una manera más estable y homogénea. Es decir, que todas las proteínas tengan la misma modificación, lo que permite mejorar la seguridad y predictibilidad”, añade el investigador.
Para ello usan un método de laboratorio llamado CRISPR/Cas9, el cual funciona como una tijera molecular para cambiar o editar piezas del ADN de una célula. “Antes era mucho más difícil porque tú ponías el ADN de la levadura y esperabas de una forma más aleatoria e inespecífica a que este se incorporara dentro del material genético y la levadura, ahora tú le puedes indicar a la célula lo que quieres que suceda de una forma más eficaz”, detalla.
El objetivo detrás de todo este esfuerzo es el desarrollo de terapias para el tratamiento de diversas enfermedades. “Podemos desarrollar proteínas para el tratamiento de la hemofilia, algunos tipos de cáncer y algunas enfermedades raras como los errores innatos del metabolismo, porque tienen proteínas muy parecidas”, puntualiza Alméciga.
Proteínas recombinantes más accesibles en el mercado
Esta investigación fue la base para la creación de la startup Dogma Biotech, que nació en julio de 2023 para llevar esta tecnología revolucionaria al mercado. “Hemos diseñado una levadura capaz de producir glicosilaciones homogéneas con una alta productividad y escalabilidad”, dice la descripción de la página web.
La administración de estas proteínas es similar a la de cualquier otro medicamento, lo que hace que las terapias sean más accesibles y fáciles de utilizar. Por eso, cuentan con el respaldo financiero de una empresa farmacéutica que está trabajando en la licencia de estos avances para luego ser usados como medicamentos.
Actualmente tienen una proteína, pero están trabajando en el desarrollo de otras cuatro, así, su plataforma podría ser utilizada para producir cualquier proteína que requiera la adición de azúcares para su funcionamiento.
A largo plazo su objetivo es que ellos mismos puedan desarrollar sus propios productos con base en las proteínas que producen. “Queremos aportar a la consolidación de lo que se conoce como soberanía sanitaria y así poder generar este tipo de productos biotecnológicos para atender nuestras necesidades y las del mundo”, comenta el investigador.
Además, Alméciga asegura que el sistema actual de producción de estas proteínas es muy costoso, pero el que ellos están desarrollando haría más económicos muchos procesos, mejorando el acceso.
Esta es una apuesta que promete no solo alto valor, sino también un impacto significativo en la medicina y una adopción generalizada de la innovación por parte de la comunidad médica y los pacientes que esperan soluciones efectivas y seguras.